Senyawa Elektrolit dan Nonelektrolit : Jenis Ikatan Senyawa dalam Larutan Elektrolit dan Nonelektrolit
Senyawa Elektrlit dan Nonelektrolit : Jenis
Ikatan Senyawa dalam Larutan
Elektrolit dan Nonelektrolit
Silahkan perhatikan bagan di bawah ini untuk mengingat tentang ikatan kimia :
Kembali diingat dari subbab sebelumnya (link) bahwa daya hantar suatu senyawa disebabkan oleh adanya kation dan anion.
Perbedaan sifat elektrolit suatu senyawa disebabkan oleh perbedaan jenis ikatan senyawa.
Senyawa Ion : Jenis ini merupakan jenis senyawa yang memiliki ikatan ion. Ikatan ion terbentuk dari atom logam dan nonlogam. Senyawa-senyawa ion dapat terionisasi menjadi kation dan anionnya.
Bagaimana daya hantar listrik dari senyawa ion berbentuk padatan, lelehan dan larutan ? Perhatikan tabel di bawah ini:
- Senyawa ion bentuk padatan. Senyawa ion padatan ini memiliki susunan yang rapat menyebabkan ion-ionnya tidak dapat bergerak dengan bebas. Ion yang tidak dapat bergerak dengan bebas itu menyebabkan senyawa ion dengan bentuk padatan tidak dapat menghantarkan listrik.
- Senyawa ion bentuk lelehan. Senyawa ion merupakan senyawa yang terdiri dari ikatan ion. Senyawa ion bentuk lelehan ini dapat menghantarkan listrik, karena terdiri atas kation dan anion yang bergerak bebas.
- Senyawa ion bentuk larutan. Senyawa ion bentuk larutan ini dapat menghantarkan listrik, karena terdiri atas ion-ion (kation dan anion) yang bergerak bebas. Ionisasi dari senyawa ion:
Ketika suatu senyawa ion dilarutkan kedalam air, senyawa yang mulanya tersusun atas ion-ion yang rapat akan mengalami hidrasi (proses terkurung dan terikatnya ion atau molekul zat terlarut oleh molekul-molekul air) sehingga air akan menyusup di sela-sela butir-butir ion yang akan menyebabkan ion-ion akan terlepas membentuk ion-ion yang bergerak bebas.
Senyawa kovalen : Jenis ini merupakan jenis senyawa yang memiliki ikatan kovalen. Ikatan kovalen terbentuk dari atom nonlogam dan nonlogam. Senyawa kovalen terdiri atas dua, yaitu kovalen polar dan kovalen nonpolar.
Kovalen Polar : Pada ikatan kovalen tidak dikenal dengan kutub negatif dan positif seperti ikatan ion, namun adanya polarisasi ikatan (perbedaan kekuatan gaya tarik terhadap pasangan elektron yang digunakan bersama) menyebabkan senyawa kovalen memiliki kutub positif dan negatif.
Pada kovalen polar (contoh: HF, HCl, HI), terjadi polarisasi ikatan yang dinyatakan sebagai keelektronegatifan. Perbedaan keelektronegatifan antaratom menyebabkan momen dipol pada kovalen polar adalah lebih dari 1 dan berbentuk asimetris. Daya hantar listrik dari senyawa kovalen polar berbentuk padatan, lelehan dan larutan dapat dilihat pada tabel di bawah ini:
- Kovalen polar bentuk padatan dan murni, tidak dapat menghantarkan listrik. Hal ini disebabkan karena molekul-molekul pada jenis ikatan ini tidak mengandung ion-ion.
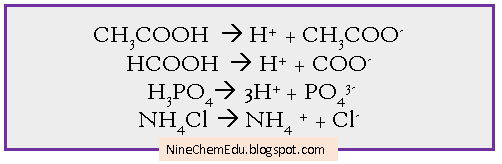
- Kovalen polar bentuk larutan, dapat menghantarkan listrik. Saat senyawa kovalen polar dilarutkan dalam air, maka ion-ion penyusun dari senyawa kovalen polar tersebut akan terurai dan bergerak bebas. Ionisasi dari senawa kovalen polar setelah dilarutkan dalam air:
Kovalen nonpolar : Senyawa kovalen nonpolar memiliki momen dipol 0, yang artinya tidak memiliki perbedaan keelektronegatifan. Tidak adanya perbedaan keelektronegatifan berarti bahwa senyawa jenis ini tidak dapat menghantarkan listrik (tidak terurai menjadi ion-ionnya). Sehingga untuk semua senyawa kovalen nonpolar merupakan senyawa yang tidak dapat menghantarkan listrik atau nonelektrolit.
Oke, ini subbab terakhir dari Bab Senyawa Elektrolit dan Nonelektrolit.
Jika ada yang ingin didiskusikan, silahkan tulis di kolom komentar :)







Comments
Post a Comment